生命的活力有賴于健全的防御機(jī)制,,小小細(xì)胞也是一樣。防御機(jī)制一旦出現(xiàn)差錯,,細(xì)胞就會變得脆弱甚至導(dǎo)致疾病,。
浙江大學(xué)醫(yī)學(xué)院腦科學(xué)與腦醫(yī)學(xué)學(xué)院白戈研究員課題組與中國科學(xué)院分子細(xì)胞科學(xué)卓越創(chuàng)新中心李勁松院士課題組開展合作研究,發(fā)現(xiàn)導(dǎo)致應(yīng)激顆粒異常的一種關(guān)鍵分子機(jī)制:參與應(yīng)激顆粒形成的核心蛋白被致病蛋白“綁架”,,應(yīng)激顆粒的組分發(fā)生改變,,其抗壓功能嚴(yán)重受損。
該研究進(jìn)一步揭示了應(yīng)激顆粒異常是導(dǎo)致多種不同亞型腓骨肌萎縮癥的共性機(jī)制,。這為針對這類神經(jīng)罕見病的廣譜治療藥物開發(fā)提供了理論基礎(chǔ),,也為其他神經(jīng)退行性疾病的機(jī)制研究提供了新思路。
1,、應(yīng)激顆粒的作用不容小覷
細(xì)胞的一生常常會面臨各種應(yīng)激,。當(dāng)危險(xiǎn)來臨,細(xì)胞會暫停胞漿內(nèi)的蛋白翻譯,,將未翻譯的信使核糖核酸(mRNA)和部分蛋白“打包壓縮”成一個個小顆粒保護(hù)起來,。
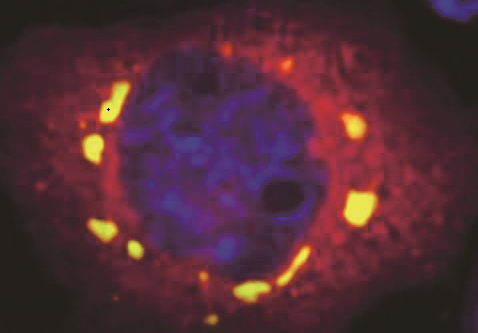
這些尺寸在0.1至2微米左右的球狀小液滴被稱為應(yīng)激顆粒(SG),它們像太陽系的行星一樣環(huán)繞在細(xì)胞核周圍,。此時細(xì)胞會將大量的“人員”轉(zhuǎn)移到安全的地方,。待到危機(jī)解除,應(yīng)激顆粒則會發(fā)生“解壓縮”而功成身退,,幫助細(xì)胞恢復(fù)正常運(yùn)轉(zhuǎn),。
“應(yīng)激顆粒可以有效避免應(yīng)激狀態(tài)下蛋白的錯誤翻譯,,組織利用細(xì)胞中的各種信號分子和能量資源,,使細(xì)胞更好應(yīng)對環(huán)境中的不良刺激,提高細(xì)胞存活率,?!闭撐墓餐ㄓ嵶髡甙赘杲榻B,作為細(xì)胞內(nèi)一個重要的防御機(jī)制,,應(yīng)激顆粒的作用不容小覷,。
研究表明,疾病蛋白在應(yīng)激顆粒中聚集并產(chǎn)生蛋白沉淀是導(dǎo)致漸凍癥,、阿爾茨海默病等多種神經(jīng)退行性疾病的一個重要機(jī)制,。
白戈平時關(guān)注一類名為腓骨肌萎縮癥的遺傳性周圍神經(jīng)病?;颊咄ǔ那嗌倌觌A段開始發(fā)病,,表現(xiàn)為四肢遠(yuǎn)端進(jìn)行性肌無力和肌萎縮并伴有感覺障礙。“包括腓骨肌萎縮癥在內(nèi)的一部分神經(jīng)系統(tǒng)疾病中并沒有發(fā)現(xiàn)病理性蛋白沉淀,?!边@讓白戈感到疑惑,“這些細(xì)胞的應(yīng)激顆粒是否存在異常呢,?”
之前發(fā)表的一項(xiàng)研究為白戈提供了重要線索,。相關(guān)功能性研究表明,當(dāng)細(xì)胞內(nèi)敲除G3BP蛋白后,,面臨不良環(huán)境刺激時細(xì)胞無法形成應(yīng)激顆粒,,增加了細(xì)胞的死亡率。
2,、“綁架”核心蛋白
在正常情況下,,G3BP蛋白均勻分布于細(xì)胞質(zhì)中。而在應(yīng)激情況下,,G3BP蛋白“臨危受命”,,作為核心組分組裝形成應(yīng)激顆粒,,眾多蛋白和核糖核酸(RNA)與之“抱團(tuán)”,,形成一個復(fù)雜的蛋白-RNA交互網(wǎng)。在顯微鏡下,,可以看到細(xì)胞內(nèi)部的物質(zhì)發(fā)生了液-液相分離現(xiàn)象,,星星點(diǎn)點(diǎn)的蛋白“抱團(tuán)”成液滴樣的應(yīng)激顆粒。
“當(dāng)致病蛋白出現(xiàn)在這張網(wǎng)絡(luò)中,,應(yīng)激顆粒會發(fā)生什么變化,?”白戈說,他們以2D型腓骨肌萎縮癥(CMT2D)中的突變蛋白GlyRS為切入點(diǎn),,探索應(yīng)激顆粒內(nèi)部網(wǎng)絡(luò)的變化,。
通過實(shí)驗(yàn),白戈課題組發(fā)現(xiàn),,在應(yīng)激狀態(tài)下,,野生型和突變型GlyRS蛋白都能夠進(jìn)入應(yīng)激顆粒中,但只有突變型GlyRS蛋白能夠與G3BP發(fā)生異常的相互作用,,擾亂以G3BP為中心的應(yīng)激顆粒網(wǎng)絡(luò),。進(jìn)一步研究顯示,突變的GlyRS蛋白導(dǎo)致應(yīng)激顆粒網(wǎng)絡(luò)互作強(qiáng)度增加,,形成了結(jié)構(gòu)更為致密的顆粒,。
“GlyRS突變蛋白與G3BP的異常相互作用不會影響應(yīng)激顆粒組裝-解聚的動態(tài)變化,卻會顯著干擾以G3BP為核心的應(yīng)激顆粒蛋白網(wǎng)絡(luò),,導(dǎo)致大量非應(yīng)激顆粒組分異常滯留在應(yīng)激顆粒中,,從而擾亂了細(xì)胞正常的應(yīng)激反應(yīng)?!卑赘暾f,,應(yīng)激顆粒受損會導(dǎo)致運(yùn)動神經(jīng)元抵御外界不良環(huán)境刺激的能力明顯下降,,更易發(fā)生軸突退變。
研究人員指出,,遺傳突變會導(dǎo)致GlyRS蛋白質(zhì)構(gòu)象發(fā)生改變,,開放出新的結(jié)構(gòu)域,使其獲得了異常的蛋白結(jié)合活性,。這個開放結(jié)構(gòu)域的存在,,導(dǎo)致突變后的GlyRS蛋白更容易和G3BP發(fā)生異常結(jié)合,使顆粒更加致密,。在腓骨肌萎縮癥小鼠模型中,,破壞這種異常的相互作用可以挽救應(yīng)激顆粒異常并緩解小鼠的運(yùn)動缺陷。
3,、發(fā)現(xiàn)“隱蔽”共性機(jī)制復(fù)雜材料
白戈課題組的研究揭示了腓骨肌萎縮癥中,,一個基因突變?nèi)绾我饝?yīng)激顆粒的功能受損,進(jìn)而導(dǎo)致疾病發(fā)生的分子機(jī)制,。這是一個極為“隱蔽”的機(jī)制,。因?yàn)閺谋砻嫔峡矗@些受損的應(yīng)激顆粒組裝-解聚的動態(tài)過程沒有異常,,也不產(chǎn)生病理性的蛋白沉淀,。病變機(jī)制隱藏在核心蛋白的網(wǎng)絡(luò)結(jié)構(gòu)中。遺傳突變導(dǎo)致突變蛋白與應(yīng)激顆粒核心蛋白形成了異常相互作用,,應(yīng)激顆粒的組分發(fā)生改變并形成致密顆粒,,最終導(dǎo)致了細(xì)胞抗壓機(jī)制的失靈。
作為臨床上常見的周圍神經(jīng)遺傳病,,腓骨肌萎縮癥的發(fā)病率約為1/2500,。根據(jù)致病基因的不同,其可以分為幾十種不同的亞型,,目前僅CMT2一個亞型就有30個以上不同的致病基因,。也就是說,腓骨肌萎縮癥幾十種不同的亞型,,其致病基因各不相同,,卻能導(dǎo)致相似的臨床表現(xiàn),醫(yī)學(xué)上這一現(xiàn)象被稱為“遺傳異質(zhì)性”,。
這些不同的致病蛋白在細(xì)胞中的定位和功能各異,,為相關(guān)治療藥物的開發(fā)帶來了極大挑戰(zhàn)。如果科學(xué)家能從中找到共性的發(fā)病機(jī)制,,就有可能實(shí)現(xiàn)利用一種藥物對多種亞型的腓骨肌萎縮癥進(jìn)行治療,。
在這項(xiàng)研究中,研究人員對25種腓骨肌萎縮癥相關(guān)突變蛋白進(jìn)行了考察。結(jié)果發(fā)現(xiàn),,在受到環(huán)境壓力的情況下,,14種突變蛋白會被招募到應(yīng)激顆粒中,其中有12種蛋白與G3BP的相互作用發(fā)生了改變,,導(dǎo)致應(yīng)激顆粒的功能受損,。
“在環(huán)境刺激下進(jìn)入應(yīng)激顆粒,可能是不同突變蛋白存在的一個共性特征,?!闭撐墓餐谝蛔髡叽耷偾僬f,“突變蛋白進(jìn)入應(yīng)激顆粒后,,可能以多種方式影響應(yīng)激顆粒的功能,。”
這種共性機(jī)制為針對多種亞型腓骨肌萎縮癥的廣譜治療藥物開發(fā)奠定了重要的理論基礎(chǔ),。